בתחום הרפואה המודרנית, אנטיביוטיקה הוכחה כאחת ההתקדמויות המשמעותיות ביותר, והורידה באופן דרמטי את שיעורי ההיארעות והתמותה הקשורים לזיהומים מיקרוביאליים. יכולתם לשנות את התוצאות הקליניות של זיהומים חיידקיים האריכה את תוחלת החיים של אינספור חולים. אנטיביוטיקה היא קריטית בהליכים רפואיים מורכבים, כולל ניתוחים, השתלות שתלים, השתלות וכימותרפיה. עם זאת, הופעתם של פתוגנים עמידים לאנטיביוטיקה הייתה דאגה גוברת, מה שמפחית את יעילותן של תרופות אלו לאורך זמן. מקרים של עמידות לאנטיביוטיקה תועדו בכל קטגוריות האנטיביוטיקה ככל שמתרחשות מוטציות מיקרוביאליות. לחץ הברירה שמפעילות תרופות אנטי-מיקרוביאליות תרם לעליית זנים עמידים, מה שמהווה אתגר משמעותי לבריאות העולמית.
כדי להתמודד עם הבעיה הדחופה של עמידות לאנטיביוטיקה, חיוני ליישם מדיניות יעילה לבקרת זיהומים אשר מצמצמת את התפשטות פתוגנים עמידים, לצד צמצום השימוש באנטיביוטיקה. יתר על כן, קיים צורך דחוף בשיטות טיפול חלופיות. טיפול בחמצן היפרברי (HBOT) התגלה כשיטה מבטיחה בהקשר זה, הכוללת שאיפת 100% חמצן ברמות לחץ ספציפיות למשך פרק זמן מסוים. HBOT, הממוקם כטיפול ראשוני או משלים לזיהומים, עשוי להציע תקווה חדשה בטיפול בזיהומים חריפים הנגרמים על ידי פתוגנים עמידים לאנטיביוטיקה.
טיפול זה מיושם יותר ויותר כטיפול ראשוני או אלטרנטיבי עבור מצבים שונים, כולל דלקות, הרעלת פחמן חד-חמצני, פצעים כרוניים, מחלות איסכמיות וזיהומים. היישומים הקליניים של HBOT בטיפול בזיהומים הם עמוקים, ומספקים יתרונות יקרי ערך לחולים.

יישומים קליניים של טיפול בחמצן היפרברי בזיהום
ראיות עדכניות תומכות באופן איתן ביישום טיפול HBOT, הן כטיפול עצמאי והן כטיפול משלים, ומציגות יתרונות משמעותיים לחולים נגועים. במהלך HBOT, לחץ החמצן בדם העורקי יכול לעלות ל-2000 מ"מ כספית, ומפלט לחץ החמצן-רקמה הגבוה הנובע מכך יכול להעלות את רמות החמצן ברקמות ל-500 מ"מ כספית. השפעות כאלה בעלות ערך מיוחד בקידום הריפוי של תגובות דלקתיות והפרעות במיקרו-מחזור הדם הנצפות בסביבות איסכמיות, כמו גם בניהול תסמונת המדור.
HBOT יכול גם להשפיע על מצבים התלויים במערכת החיסון. מחקרים מצביעים על כך ש-HBOT יכול לדכא תסמונות אוטואימוניות ותגובות חיסוניות הנגרמות על ידי אנטיגנים, ובכך לסייע בשמירה על סבילות השתל על ידי הפחתת זרימת הלימפוציטים והלויקוציטים תוך ויסות תגובות חיסוניות. בנוסף, HBOTתומך בריפויבנגעי עור כרוניים על ידי עידוד אנגיוגנזה, תהליך קריטי לשיפור ההחלמה. טיפול זה מעודד גם היווצרות של מטריצת קולגן, שלב חיוני בריפוי פצעים.
יש להקדיש תשומת לב מיוחדת לזיהומים מסוימים, במיוחד זיהומים עמוקים וקשים לטיפול כגון דלקת נמקית של הפאשיטי, אוסטאומיאליטיס, זיהומים כרוניים של רקמות רכות ואנדוקרדיטיס זיהומית. אחד היישומים הקליניים הנפוצים ביותר של HBOT הוא לטיפול בזיהומים של עור ורקמות רכות ואוסטאומיאליטיס הקשורים לרמות חמצן נמוכות, שלעתים קרובות נגרמות על ידי חיידקים אנאירוביים או עמידים.
1. זיהומים בכף הרגל הסוכרתית
כף רגל סוכרתיתכיבים הם סיבוך שכיח בקרב חולי סוכרת, ומשפיעים על עד 25% מאוכלוסייה זו. זיהומים מופיעים לעיתים קרובות בכיבים אלה (המהווים 40%-80% מהמקרים) ומובילים לעלייה בתחלואה ותמותה. זיהומים בכף הרגל הסוכרתית (DFIs) מורכבים בדרך כלל מזיהומים רב-מיקרוביאליים עם מגוון פתוגנים חיידקיים אנאירוביים שזוהו. גורמים שונים, כולל פגמים בתפקוד פיברובלסטים, בעיות ביצירת קולגן, מנגנוני חיסון תאיים ותפקוד פגוציטים, יכולים לעכב ריפוי פצעים בחולי סוכרת. מספר מחקרים זיהו פגיעה בחמצון העור כגורם סיכון חזק לקטיעות הקשורות ל-DFIs.
כאחת האפשרויות הנוכחיות לטיפול ב-DFIדווח כי טיפול HBOT משפר משמעותית את שיעורי הריפוי של פצעי כף רגל סוכרתיים, ובכך מפחית את הצורך בקטיעות ובהתערבויות כירורגיות מסובכות. טיפול זה לא רק ממזער את הצורך בהליכים עתירי משאבים, כגון ניתוחי מתלים והשתלת עור, אלא גם מציג עלויות נמוכות יותר ותופעות לוואי מינימליות בהשוואה לאפשרויות כירורגיות. מחקר של צ'ן ועמיתיו הראה כי יותר מ-10 מפגשים של HBOT הובילו לשיפור של 78.3% בשיעורי ריפוי פצעים בחולי סוכרת.
2. זיהומים נמקיים של רקמות רכות
זיהומים נמקיים ברקמות רכות (NSTIs) הם לרוב רב-מיקרוביאליים, נובעים בדרך כלל משילוב של פתוגנים חיידקיים אירוביים ואנאירוביים, ולעיתים קרובות קשורים לייצור גזים. בעוד ש-NSTIs הם נדירים יחסית, הם מציגים שיעור תמותה גבוה עקב התקדמותם המהירה. אבחון וטיפול בזמן ומתאים הם המפתח להשגת תוצאות חיוביות, ו-HBOT הומלץ כשיטה משלימה לניהול NSTIs. למרות שעדיין קיימת מחלוקת סביב השימוש ב-HBOT ב-NSTIs עקב היעדר מחקרים פרוספקטיביים מבוקרים,ראיות מצביעות על כך שייתכן שזה קשור לשיעורי הישרדות משופרים ושימור איברים בחולי NSTIמחקר רטרוספקטיבי הצביע על ירידה משמעותית בשיעורי התמותה בקרב חולי NSTI שקיבלו HBOT.
1.3 זיהומים באתר ניתוח
ניתן לסווג זיהומים במערכת העיכול (SSI) על סמך האתר האנטומי של הזיהום והם יכולים לנבוע ממגוון פתוגנים, כולל חיידקים אירוביים ואנאירוביים כאחד. למרות ההתקדמות באמצעי בקרת זיהומים, כגון טכניקות עיקור, שימוש באנטיביוטיקה פרופילקטית ושיפורים בשיטות הכירורגיות, זיהומים במערכת העיכול נותרים סיבוך מתמשך.
סקירה משמעותית אחת בחנה את יעילותה של HBOT במניעת זיהומים עמוקים ב-SSI בניתוחי עקמת עצבית-שרירית. HBOT טרום ניתוחי עשוי להפחית משמעותית את שכיחות זיהומים ב-SSI ולהקל על ריפוי פצעים. טיפול לא פולשני זה יוצר סביבה שבה רמות החמצן ברקמות הפצע גבוהות, דבר שנקשר לפעולת חימצון נגד פתוגנים. בנוסף, הוא מטפל ברמות הנמוכות בדם ובחמצן התורמות להתפתחות זיהומים ב-SSI. מעבר לאסטרטגיות אחרות לבקרת זיהומים, HBOT הומלץ במיוחד עבור ניתוחים מזוהמים נקיים כמו הליכים של המעי הגס.
1.4 כוויות
כוויות הן פציעות הנגרמות מחום קיצוני, זרם חשמלי, כימיקלים או קרינה ויכולות להוביל לשיעורי תחלואה ותמותה גבוהים. HBOT מועיל בטיפול בכוויות על ידי העלאת רמות החמצן ברקמות פגועות. בעוד שמחקרים בבעלי חיים ובמחקרים קליניים מציגים תוצאות מעורבות בנוגע...יעילות ה-HBOT בטיפול בכוויות, מחקר שכלל 125 חולי כוויות הראה כי טיפול HBOT לא הראה השפעה משמעותית על שיעורי התמותה או על מספר הניתוחים שבוצעו, אך כן הפחית את זמן הריפוי הממוצע (19.7 ימים לעומת 43.8 ימים). שילוב HBOT עם ניהול מקיף של כוויות יכול לשלוט ביעילות בספסיס בחולי כוויות, מה שמוביל לזמני ריפוי קצרים יותר ולהפחתת צריכת נוזלים. עם זאת, נדרש מחקר פרוספקטיבי נרחב נוסף כדי לאשר את תפקידו של HBOT בניהול כוויות נרחבות.
1.5 אוסטאומיאליטיס
אוסטאומיאליטיס היא זיהום של העצם או מח העצם, הנגרם לעיתים קרובות על ידי פתוגנים חיידקיים. טיפול באוסטאומיאליטיס יכול להיות מאתגר עקב אספקת הדם הדלה יחסית לעצמות והחדירה המוגבלת של אנטיביוטיקה למוח העצם. אוסטאומיאליטיס כרונית מאופיינת בפתוגנים מתמשכים, דלקת קלה ויצירת רקמת עצם נמקית. אוסטאומיאליטיס עמידה מתייחסת לזיהומים כרוניים בעצם הנמשכים או חוזרים למרות טיפול מתאים.
HBOT הוכח כמשפר משמעותית את רמות החמצן ברקמות העצם הנגועות. סדרות מקרים רבות ומחקרי עוקבה מצביעים על כך ש-HBOT משפר את התוצאות הקליניות עבור חולי אוסטאומיאליטיס. נראה כי הוא פועל באמצעות מנגנונים שונים, כולל הגברת הפעילות המטבולית, דיכוי פתוגנים חיידקיים, שיפור השפעות אנטיביוטיות, מזעור דלקת וקידום ריפוי.תהליכים. לאחר טיפול HBOT, 60% עד 85% מהחולים עם אוסטאומיאליטיס כרונית ועמידה מראים סימנים של דיכוי זיהום.
1.6 זיהומים פטרייתיים
ברחבי העולם, למעלה משלושה מיליון אנשים סובלים מזיהומים פטרייתיים כרוניים או פולשניים, מה שמוביל ליותר מ-600,000 מקרי מוות מדי שנה. תוצאות הטיפול בזיהומים פטרייתיים נפגעות לעיתים קרובות עקב גורמים כמו שינוי במצב החיסוני, מחלות רקע ומאפייני אלימות הפתוגן. HBOT הופך לאופציה טיפולית אטרקטיבית בזיהומים פטרייתיים חמורים בשל בטיחותו ואופיו הלא פולשני. מחקרים מצביעים על כך ש-HBOT יכול להיות יעיל כנגד פתוגנים פטרייתיים כמו אספרגילוס ו-Mycobacterium tuberculosis.
HBOT מקדם השפעות נגד פטריות על ידי עיכוב היווצרות הביופילם של אספרגילוס, כאשר יעילות מוגברת נצפית בזנים החסרים גנים של סופראוקסיד דיסמוטאז (SOD). תנאי ההיפוקסיה במהלך זיהומים פטרייתיים מציבים אתגרים למתן תרופות נגד פטריות, מה שהופך את רמות החמצן המוגברות מ-HBOT להתערבות פוטנציאלית מועילה, אם כי יש צורך במחקר נוסף.
התכונות האנטי-מיקרוביאליות של HBOT
הסביבה ההיפרוקסית הנוצרת על ידי HBOT יוזמת שינויים פיזיולוגיים וביוכימיים המעוררים תכונות אנטיבקטריאליות, מה שהופך אותו לטיפול משלים יעיל לזיהומים. HBOT מדגים השפעות יוצאות דופן כנגד חיידקים אירוביים ובעיקר חיידקים אנאירוביים באמצעות מנגנונים כגון פעילות חיידקית ישירה, הגברת תגובות חיסוניות והשפעות סינרגטיות עם חומרים אנטי-מיקרוביאליים ספציפיים.
2.1 השפעות אנטיבקטריאליות ישירות של HBOT
ההשפעה האנטיבקטריאלית הישירה של HBOT מיוחסת במידה רבה ליצירת מיני חמצן ריאקטיביים (ROS), הכוללים אניוני סופראוקסיד, מי חמצן, רדיקלים הידרוקסיל ויוני הידרוקסיל - שכולם נוצרים במהלך חילוף החומרים התאי.
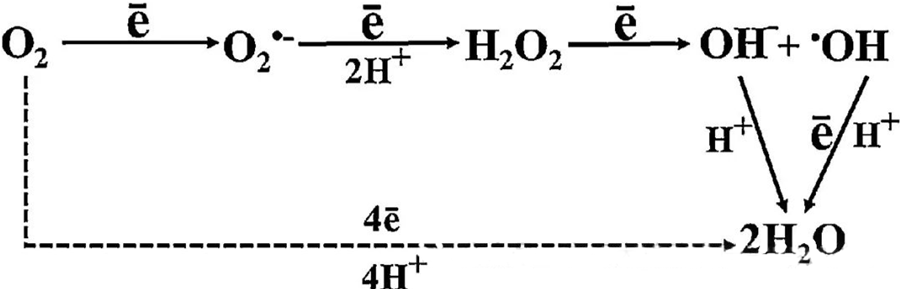
האינטראקציה בין O₂ לרכיבים תאיים חיונית להבנת האופן שבו ROS נוצרים בתוך תאים. בתנאים מסוימים המכונים עקה חמצונית, האיזון בין היווצרות ROS לפירוקו מופר, מה שמוביל לרמות גבוהות של ROS בתאים. ייצור הסופראוקסיד (O₂⁻) מזורז על ידי סופראוקסיד דיסמוטאז, אשר לאחר מכן ממיר O₂⁻ למי חמצן (H₂O₂). המרה זו מוגברת עוד יותר על ידי תגובת פנטון, אשר מחמצנת Fe²⁺ ליצירת רדיקלים הידרוקסיליים (·OH) ו-Fe³⁺, ובכך מתחילה רצף חמצון-חיזור מזיק של היווצרות ROS ונזק תאי.
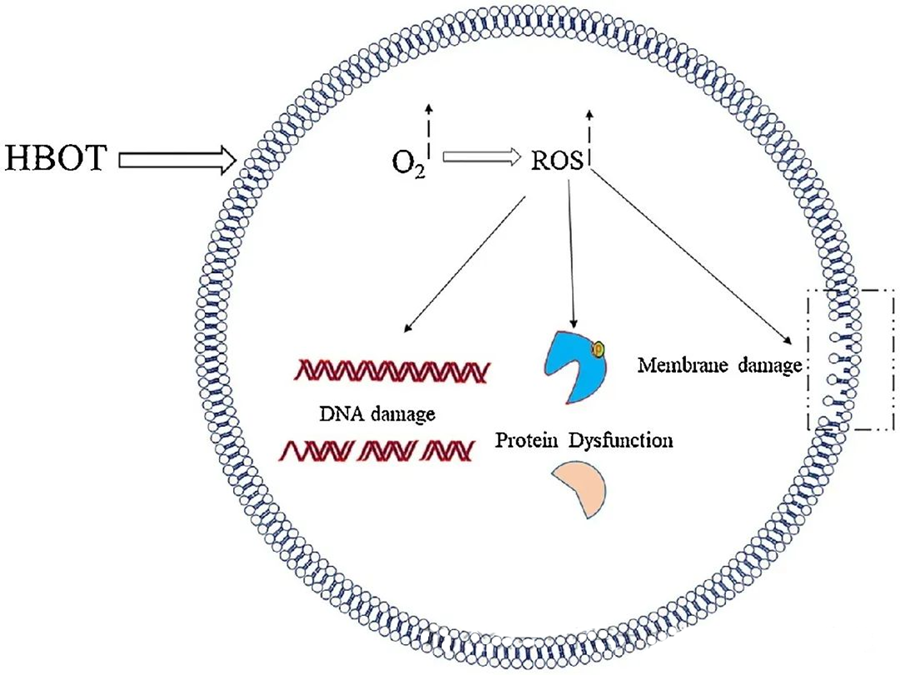
ההשפעות הרעילות של ROS מתמקדות ברכיבים תאיים קריטיים כגון DNA, RNA, חלבונים וליפידים. ראוי לציין כי DNA הוא מטרה עיקרית של ציטוטוקסיות בתיווך H₂O₂, מכיוון שהוא משבש את מבני הדאוקסיריבוז ופוגע בהרכבי הבסיסים. הנזק הפיזי הנגרם על ידי ROS משתרע על מבנה הסליל של ה-DNA, ויכול לנבוע מחמצון שומנים המופעל על ידי ROS. זה מדגיש את ההשלכות השליליות של רמות ROS גבוהות במערכות ביולוגיות.
פעולה אנטי-מיקרוביאלית של ROS
ל-ROS תפקיד חיוני בעיכוב גדילה מיקרוביאלית, כפי שהודגם באמצעות יצירת ROS המושרה על ידי HBOT. ההשפעות הרעילות של ROS מכוונות ישירות למרכיבים תאיים כמו DNA, חלבונים וליפידים. ריכוזים גבוהים של מיני חמצן פעילים עלולים לפגוע ישירות בליפידים, מה שמוביל לחמצון שומנים. תהליך זה פוגע בשלמות קרומי התא, וכתוצאה מכך, בתפקוד של קולטנים וחלבונים הקשורים לממברנה.
יתר על כן, חלבונים, שהם גם מטרות מולקולריות משמעותיות של ROS, עוברים שינויים חמצוניים ספציפיים בשאריות חומצות אמינו שונות כגון ציסטאין, מתיונין, טירוזין, פנילאלנין וטריפטופן. לדוגמה, HBOT הוכח כגורם לשינויים חמצוניים במספר חלבונים ב-E. coli, כולל גורם התארכות G ו-DnaK, ובכך משפיע על תפקודיהם התאיים.
שיפור החסינות באמצעות HBOT
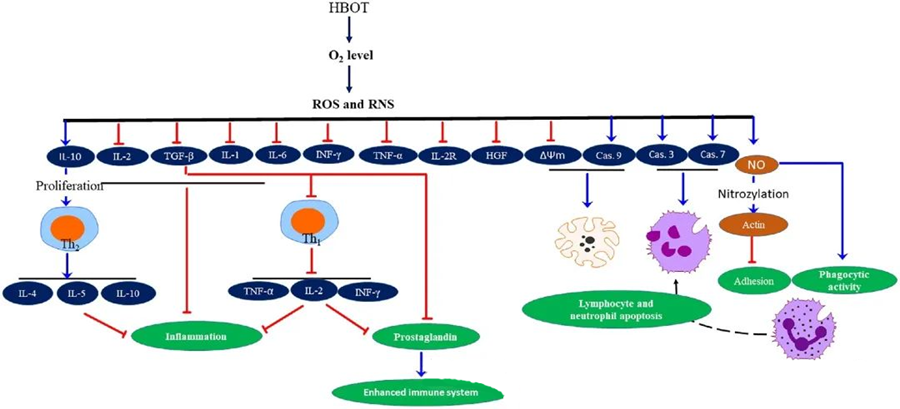
התכונות האנטי-דלקתיות של HBOTתועדו, והוכחו כחיוניים להקלה על נזק לרקמות ולדיכוי התקדמות זיהום. HBOT משפיע באופן משמעותי על הביטוי של ציטוקינים ווסתים דלקתיים אחרים, ומשפיע על התגובה החיסונית. מערכות ניסוי שונות הבחינו בשינויים דיפרנציאליים בביטוי גנים וביצירת חלבונים לאחר HBOT, אשר מעלה או מורידה את רמת גורמי הגדילה והציטוקינים.
במהלך תהליך HBOT, רמות מוגברות של O₂ מפעילות מגוון תגובות תאיות, כגון דיכוי שחרור של מתווכים דלקתיים וקידום אפופטוזיס של לימפוציטים ונויטרופילים. יחד, פעולות אלו משפרות את המנגנונים האנטי-מיקרוביאליים של מערכת החיסון, ובכך מקלות על ריפוי זיהומים.
יתר על כן, מחקרים מצביעים על כך שרמות מוגברות של O₂ במהלך טיפול HBOT יכולות להפחית את הביטוי של ציטוקינים מעודדי דלקת, כולל אינטרפרון גמא (IFN-γ), אינטרלוקין-1 (IL-1) ואינטרלוקין-6 (IL-6). שינויים אלה כוללים גם הפחתת היחס בין תאי T CD4:CD8 וויסות קולטנים מסיסים אחרים, ובסופו של דבר מעלה את רמות האינטרלוקין-10 (IL-10), שהיא חיונית להתמודדות עם דלקת ולקידום ריפוי.
הפעילות האנטי-מיקרוביאלית של HBOT כרוכת במנגנונים ביולוגיים מורכבים. דווח כי גם סופראוקסיד וגם לחץ דם מוגבר מקדמים באופן לא עקבי פעילות אנטי-בקטריאלית ואפופטוזיס נויטרופילים הנגרמת על ידי HBOT. בעקבות HBOT, עלייה ניכרת ברמות החמצן משפרת את היכולות הבקטריאליות של נויטרופילים, מרכיב חיוני בתגובה החיסונית. יתר על כן, HBOT מדכא הידבקות נויטרופילים, המתווכת על ידי אינטראקציה של β-אינטגרינים על נויטרופילים עם מולקולות הידבקות בין-תאיות (ICAM) על תאי אנדותל. HBOT מעכב את פעילות האינטגרין β-2 של נויטרופילים (Mac-1, CD11b/CD18) באמצעות תהליך המתווך על ידי תחמוצת החנקן (NO), ותורם לנדידת נויטרופילים לאתר הזיהום.
סידור מחדש מדויק של שלד התא נחוץ כדי שנויטרופילים יוכלו לבצע פגוציטים ביעילות דרך פתוגנים. ניטרוזילציה של S של אקטין הוכחה כמגרה פולימריזציה של אקטין, מה שעשוי להקל על הפעילות הפגוציטית של נויטרופילים לאחר טיפול מקדים ב-HBOT. יתר על כן, HBOT מקדם אפופטוזיס בקווי תאי T אנושיים דרך מסלולים מיטוכונדריאליים, כאשר דווח על מוות לימפוציטים מואץ לאחר HBOT. חסימת קספאז-9 - מבלי להשפיע על קספאז-8 - הוכיחה את ההשפעות האימונומודולטוריות של HBOT.
ההשפעות הסינרגטיות של HBOT עם חומרים אנטי-מיקרוביאליים
ביישומים קליניים, טיפול HBOT משמש לעתים קרובות לצד אנטיביוטיקה כדי להילחם ביעילות בזיהומים. המצב ההיפר-חמצני המושג במהלך HBOT יכול להשפיע על יעילותם של חומרים אנטיביוטיים מסוימים. מחקרים מצביעים על כך שתרופות אנטיבקטריאליות ספציפיות, כגון β-לקטמים, פלואורוקינולונים ואמינוגליקוזידים, פועלות לא רק באמצעות מנגנונים טבעיים אלא גם מסתמכות באופן חלקי על חילוף החומרים האירובי של חיידקים. לכן, נוכחות חמצן והמאפיינים המטבוליים של פתוגנים הם מכריעים בעת הערכת ההשפעות הטיפוליות של אנטיביוטיקה.
ראיות משמעותיות הראו כי רמות חמצן נמוכות יכולות להגביר את העמידות של Pseudomonas aeruginosa לפיפרצילין/טאזובקטם וכי סביבה דלת חמצן תורמת גם היא לעמידות מוגברת של Enterobacter cloacae לאזיתרומיצין. לעומת זאת, מצבים היפוקסיים מסוימים עשויים להגביר את הרגישות החיידקית לאנטיביוטיקה ממשפחת טטרציקלין. HBOT משמש כשיטה טיפולית משלימה בת קיימא על ידי השראה של מטבוליזם אירובי וחמצון מחדש של רקמות נגועות היפוקסיות, ובכך להגביר את רגישות הפתוגנים לאנטיביוטיקה.
במחקרים פרה-קליניים, השילוב של HBOT - שניתן פעמיים ביום למשך 8 שעות בלחץ של 280 קילו-פסקל - יחד עם טוברמיצין (20 מ"ג/ק"ג/יום) הפחית משמעותית את עומסי החיידקים באנדוקרדיטיס זיהומית מסוג סטפילוקוקוס אאורוס. ממצא זה מדגים את הפוטנציאל של HBOT כטיפול עזר. מחקרים נוספים גילו שתחת 37 מעלות צלזיוס ולחץ של 3 ATA למשך 5 שעות, HBOT הגביר באופן משמעותי את השפעות האימיפנם כנגד Pseudomonas aeruginosa הנגוע במקרופאגים. בנוסף, נמצא כי הטיפול המשולב של HBOT עם צפאזולין יעיל יותר בטיפול באוסטאומיאליטיס מסוג סטפילוקוקוס אאורוס במודלים של בעלי חיים בהשוואה לצפאזולין בלבד.
HBOT גם מגביר משמעותית את הפעולה הבקטריאלית של ציפרופלוקסצין כנגד ביופילמים של Pseudomonas aeruginosa, במיוחד לאחר 90 דקות של חשיפה. שיפור זה מיוחס להיווצרות של מיני חמצן פעילים אנדוגניים (ROS) ומציג רגישות מוגברת במוטנטים פגומים בפרוקסידאז.
במודלים של דלקת קרום הפלאוריטיס הנגרמת על ידי סטפילוקוקוס אאורוס עמיד למתיצילין (MRSA), הפעולה המשותפת של ונקומיצין, טיקופלנין ולינזוליד עם HBOT הראתה יעילות מוגברת משמעותית כנגד MRSA. מטרונידאזול, אנטיביוטיקה הנמצאת בשימוש נרחב לטיפול בזיהומים אנאירוביים ופולימיקרוביאליים חמורים כגון זיהומים בכף הרגל הסוכרתית (DFIs) וזיהומים באתר ניתוח (SSIs), הפגינה יעילות אנטי-מיקרוביאלית גבוהה יותר בתנאים אנאירוביים. מחקרים עתידיים מוצדקים כדי לבחון את ההשפעות האנטיבקטריאליות הסינרגטיות של HBOT בשילוב עם מטרונידאזול הן בתנאים in vivo והן בתנאים in vitro.
היעילות האנטי-מיקרוביאלית של HBOT על חיידקים עמידים
עם האבולוציה וההתפשטות של זנים עמידים, אנטיביוטיקה מסורתית מאבדת לעיתים קרובות את יעילותה עם הזמן. יתר על כן, HBOT עשוי להוכיח את עצמו כחיוני בטיפול ובמניעה של זיהומים הנגרמים על ידי פתוגנים עמידים לתרופות מרובות, ומשמש כאסטרטגיה קריטית כאשר טיפולים אנטיביוטיים נכשלים. מחקרים רבים דיווחו על ההשפעות הבקטריאליות המשמעותיות של HBOT על חיידקים עמידים בעלי משמעות קלינית. לדוגמה, טיפול HBOT בן 90 דקות בקצב של 2 אטמוספרות הפחית באופן משמעותי את הגדילה של MRSA. בנוסף, במודלים של יחס, HBOT הגביר את ההשפעות האנטיבקטריאליות של אנטיביוטיקה שונות כנגד זיהומי MRSA. דיווחים אישרו כי HBOT יעיל בטיפול באוסטאומיאליטיס הנגרמת על ידי Klebsiella pneumoniae המייצרת OXA-48 מבלי להזדקק לאנטיביוטיקה משלימה.
לסיכום, טיפול בחמצן היפרברי מייצג גישה רב-גונית לבקרת זיהומים, המשפרת את התגובה החיסונית תוך הגברת יעילותם של חומרים אנטי-מיקרוביאליים קיימים. בעזרת מחקר ופיתוח מקיפים, יש לו פוטנציאל למתן את השפעות העמידות לאנטיביוטיקה, ומציע תקווה במאבק המתמשך בזיהומים חיידקיים.
זמן פרסום: 28 בפברואר 2025

